தொடர்பு திறன் வேறுபாடு
இரண்டு வெவ்வேறு உலோகங்களால் செய்யப்பட்ட இரண்டு மாதிரிகள் ஒன்றாக இறுக்கமாக அழுத்தப்பட்டால், அவற்றுக்கிடையே தொடர்பு சாத்தியமான வேறுபாடு ஏற்படும். இத்தாலிய இயற்பியலாளர், வேதியியலாளர் மற்றும் உடலியல் நிபுணர் அலெஸாண்ட்ரோ வோல்டா 1797 இல் உலோகங்களின் மின் பண்புகளை ஆய்வு செய்யும் போது இந்த நிகழ்வைக் கண்டுபிடித்தார்.

இந்த வரிசையில் உலோகங்களை ஒரு சங்கிலியில் இணைத்தால், வோல்டா கண்டறிந்தது: Al, Zn, Sn, Pb, Bi, Hg, Fe, Cu, Ag, Au, Pt, Pd, அதன் விளைவாக வரும் சங்கிலியில் உள்ள ஒவ்வொரு உலோகமும் பெறப்படும். ஒரு திறன் - முந்தையதை விட குறைவு. மேலும், இந்தச் சுற்றில் இந்த உலோகங்களின் ஏற்பாட்டின் வரிசையைப் பொருட்படுத்தாமல், இந்த வழியில் இணைந்த பல உலோகங்கள் உருவான சுற்றுகளின் முனைகளுக்கு இடையில் ஒரே சாத்தியமான வேறுபாட்டைக் கொடுக்கும் என்று விஞ்ஞானி கண்டறிந்தார் - இந்த நிலை இப்போது வோல்டாவின் தொடர் தொடர்புகளின் விதி என்று அழைக்கப்படுகிறது. .
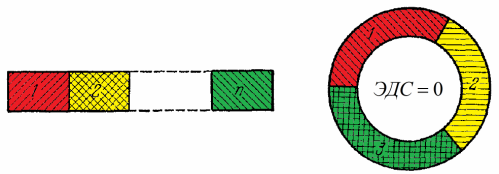
தொடர்பு வரிசையின் சட்டத்தை சரியாகச் செயல்படுத்த, முழு உலோக சுற்றும் ஒரே வெப்பநிலையில் இருப்பது அவசியம் என்பதை இங்கே புரிந்துகொள்வது மிகவும் முக்கியம்.
இந்த சுற்று இப்போது அதன் முனைகளில் இருந்து மூடப்பட்டிருந்தால், சுற்றுவட்டத்தில் உள்ள EMF பூஜ்ஜியமாக இருக்கும் என்று சட்டத்தில் இருந்து பின்பற்றுகிறது.ஆனால் இவை அனைத்தும் (உலோகம் 1, உலோகம் 2, உலோகம் 3) ஒரே வெப்பநிலையில் இருந்தால் மட்டுமே, இல்லையெனில் இயற்கையின் அடிப்படை விதி - ஆற்றல் பாதுகாப்பு விதி - மீறப்படும்.
வெவ்வேறு ஜோடி உலோகங்களுக்கு, தொடர்பு திறன் வேறுபாடு ஒரு வோல்ட்டின் பத்தில் மற்றும் நூறில் ஒரு சில வோல்ட் வரை இருக்கும்.
தொடர்பு சாத்தியமான வேறுபாட்டின் தோற்றத்திற்கான காரணத்தை புரிந்து கொள்ள, இலவச எலக்ட்ரான் மாதிரியைப் பயன்படுத்துவது வசதியானது.
ஜோடியின் இரண்டு உலோகங்களும் முழுமையான பூஜ்ஜிய வெப்பநிலையில் இருக்கட்டும், பின்னர் ஃபெர்மி வரம்பு உட்பட அனைத்து ஆற்றல் நிலைகளும் எலக்ட்ரான்களால் நிரப்பப்படும். ஃபெர்மி ஆற்றலின் மதிப்பு (வரம்பு) உலோகத்தில் கடத்தும் எலக்ட்ரான்களின் செறிவுடன் பின்வருமாறு தொடர்புடையது:
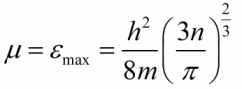
m என்பது எலக்ட்ரானின் மீதமுள்ள நிறை, h என்பது பிளாங்கின் மாறிலி, n என்பது கடத்தும் எலக்ட்ரான்களின் செறிவு
இந்த விகிதத்தை கணக்கில் எடுத்துக்கொண்டால், வெவ்வேறு ஃபெர்மி ஆற்றல்களைக் கொண்ட இரண்டு உலோகங்களை நெருங்கிய தொடர்புக்கு கொண்டு வருகிறோம், எனவே கடத்தல் எலக்ட்ரான்களின் வெவ்வேறு செறிவுகளுடன்.
இரண்டாவது உலோகம் கடத்தல் எலக்ட்ரான்களின் அதிக செறிவு கொண்டது என்றும், அதன்படி இரண்டாவது உலோகத்தின் ஃபெர்மி அளவு முதல் உலோகத்தை விட அதிகமாக உள்ளது என்றும் நாம் எடுத்துக்கொள்வோம்.
பின்னர், உலோகங்கள் ஒன்றோடொன்று தொடர்பு கொள்ளும்போது, உலோகம் 2 முதல் உலோகம் 1 வரை எலக்ட்ரான்களின் பரவல் (ஒரு உலோகத்திலிருந்து மற்றொரு உலோகத்திற்கு ஊடுருவல்) தொடங்கும், ஏனெனில் உலோகம் 2 முதல் உலோகத்தின் ஃபெர்மி நிலைக்கு மேலே உள்ள ஆற்றல் மட்டங்களை நிரப்பியுள்ளது. , அதாவது இந்த நிலைகளில் இருந்து எலக்ட்ரான்கள் உலோக 1 காலியிடங்களை நிரப்பும்.
அத்தகைய சூழ்நிலையில் எலக்ட்ரான்களின் தலைகீழ் இயக்கம் ஆற்றலுடன் சாத்தியமற்றது, ஏனெனில் இரண்டாவது உலோகத்தில் அனைத்து குறைந்த ஆற்றல் மட்டங்களும் ஏற்கனவே முழுமையாக நிரப்பப்பட்டுள்ளன.இறுதியில், உலோகம் 2 நேர்மறையாகவும், உலோகம் 1 எதிர்மறையாகவும் மாறும், அதே சமயம் முதல் உலோகத்தின் ஃபெர்மி அளவு அதை விட அதிகமாகும், மேலும் இரண்டாவது உலோகத்தின் அளவு குறையும். இந்த மாற்றம் பின்வருமாறு இருக்கும்:
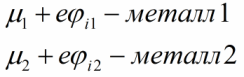
இதன் விளைவாக, தொடர்பு உலோகங்கள் மற்றும் தொடர்புடைய மின்சார புலம் இடையே ஒரு சாத்தியமான வேறுபாடு எழும், இது இப்போது எலக்ட்ரான்களின் மேலும் பரவலைத் தடுக்கும்.
இரண்டு உலோகங்களின் ஃபெர்மி அளவுகளின் சமத்துவத்துடன் தொடர்புடைய சாத்தியமான வேறுபாடு ஒரு குறிப்பிட்ட மதிப்பை அடையும் போது அதன் செயல்முறை முற்றிலும் நிறுத்தப்படும், இதில் உலோகம் 2 இலிருந்து புதிதாக வந்த எலக்ட்ரான்களுக்கு உலோகம் 1 இல் இலவச நிலைகள் இருக்காது, மற்றும் உலோகம் 2 இல் உலோகத்தில் இருந்து எலக்ட்ரான் இடம்பெயர்வு சாத்தியம் மீது எந்த நிலைகளும் விடுவிக்கப்படாது 1. ஆற்றல் சமநிலை வரும்:

எலக்ட்ரானின் சார்ஜ் எதிர்மறையாக இருப்பதால், ஆற்றல்களுடன் தொடர்புடைய பின்வரும் நிலையைப் பெறுவோம்:

உலோகங்களின் வெப்பநிலையானது முழுமையான பூஜ்ஜியமாக இருக்கும் என்று நாம் முதலில் கருதினாலும், இதே முறையில் எந்த வெப்பநிலையிலும் சமநிலை ஏற்படும்.
ஒரு மின்சார புலத்தின் முன்னிலையில் உள்ள ஃபெர்மி ஆற்றல் என்பது ஒரு எலக்ட்ரான் வாயுவில் உள்ள ஒரு எலக்ட்ரானின் இரசாயன ஆற்றலைத் தவிர வேறொன்றுமில்லை. சமமாக இருக்கும், வெப்பநிலையில் இரசாயன ஆற்றலைச் சார்ந்திருப்பதை கருத்தில் கொள்வது மட்டுமே அவசியம்.
எனவே, எங்களால் கருதப்படும் சாத்தியமான வேறுபாடு உள் தொடர்பு சாத்தியமான வேறுபாடு என்று அழைக்கப்படுகிறது மற்றும் தொடர் தொடர்புகளுக்கான வோல்டாவின் சட்டத்திற்கு ஒத்திருக்கிறது.
இந்த சாத்தியமான வேறுபாட்டை மதிப்பிடுவோம், இதற்காக ஃபெர்மி ஆற்றலை கடத்தும் எலக்ட்ரான்களின் செறிவின் அடிப்படையில் வெளிப்படுத்துகிறோம், பின்னர் மாறிலிகளின் எண் மதிப்புகளை மாற்றுகிறோம்:
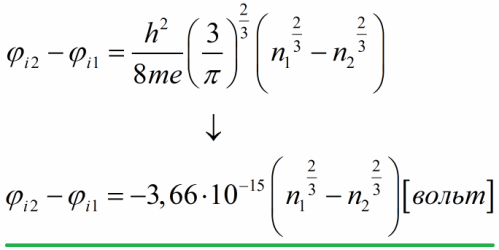
எனவே, இலவச எலக்ட்ரான் மாதிரியின் அடிப்படையில், உலோகங்களுக்கான உள் தொடர்பு சாத்திய வேறுபாடு ஒரு வோல்ட்டின் நூறில் ஒரு பங்கு முதல் பல வோல்ட் வரையிலான அளவின் வரிசையில் உள்ளது.
